AKKURAT NÅ

Revolusjonerende norsk kreftmedisin
Men prosjektet mangler penger
Det har tatt 18 år, men nå har professor Marit Otterlei laget en helt ny type kreftmedisin. Ingen lignende medisiner har kommet så langt i utviklingen på verdensbasis. Det er bare et problem: de mangler penger.
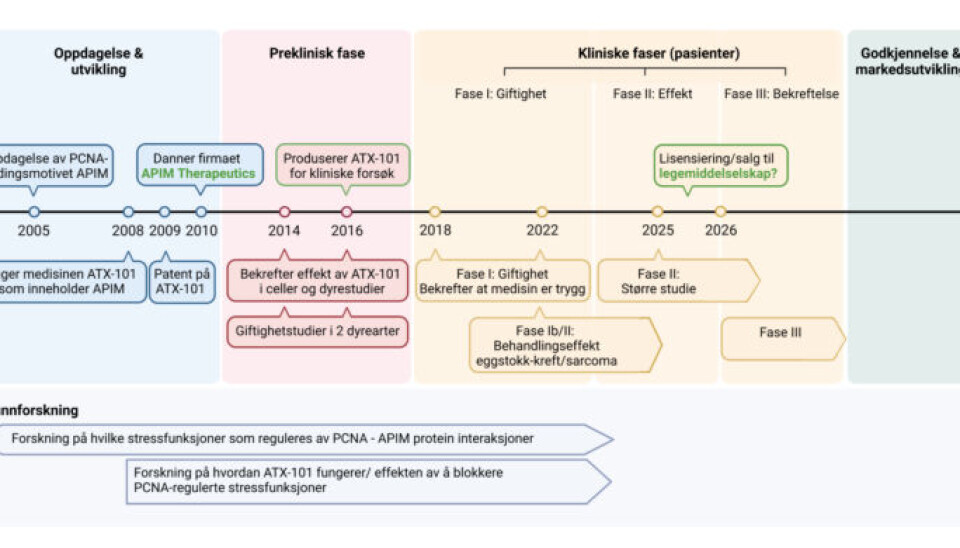
For første gang har en kreftmedisin blitt utviklet ved NTNU og en spin-off fra NTNU, APIM Therapeutics.
NTNU har stått for grunnforskningen. APIM Therapeutics har brukt grunnforskningen for å utvikle medisinen.
Det har tatt 18 år, og over 200 millioner kroner.
Nå har medisinen blitt testet på 20 mennesker som var dødssyke på grunn av kreft. De hadde prøvd alt, og som en siste mulighet ønsket de å prøve noe som var på forsøksstadiet.
Kreften sluttet å vokse
Forsøkene foregikk i Australia hvor det er klinikker som er spesialister på utprøving av nye medisiner.
Resultatene er svært lovende, og publisert i et anerkjent tidsskrift for kreftforskning.
70 prosent av de som testet medisinen var stabile etter seks uker. Tolv fortsatte med medisinen og var stabile i 18 uker. En kvinne tok medisinen i 17 måneder, og var stabil i over to år.
Det vil si at kreften sluttet å vokse.
Målet med testingen i Australia var ikke først og fremst å sjekke om medisinen funket. Målet var å sjekke om medisinen var giftig på mennesker.
Det var den absolutt ikke.
På laboratoriet og i dyreforsøk har medisinen tidligere vist seg å både holde kreften i sjakk, og ta knekken på den.
Bak det hele står Marit Otterlei. Hun er professor i molekylær medisin ved NTNU.
Slipper å miste håret
Ved kreft har det oppstått skader i cellens arvestoff, slik at cellene deler seg ukontrollert. Etter hvert blir det en opphopning av skadede celler, og det dannes til slutt en kreftsvulst.
– Kreftceller er mer stresset enn andre celler. Samtidig dør de ikke, men fortsetter å vokse selv om de er skadet. Vanlig kreftbehandling med cellegift påfører kreftcellen mer stress slik at cellene til slutt dør. Cellegift virker på alle celler, også de normale, for eksempel i hårsekkene, og påvirker dermed hele kroppen med mange bivirkninger som hårtap, forklarer Otterlei.
Det er her hennes oppfinnelse skiller seg ut.
I USA skal kreftmedisinen nå testes på pasienter med sarkom, en type bindevevskreft og i Australia skal medisinen testes på kreft i eggstokkene – begge de kliniske forsøkene er i kombinasjon med cellegift. Det forteller Marit Otterlei, professor ved NTNU. Foto: Geir Mogen
Den nye kreftmedisinen som Otterlei har laget heter ATX-101. Den virker kun på stressede kreftceller, og lar de andre friske cellene i kroppen være i fred.
– Kreftpasientene slipper dermed blant annet å miste håret. ATX-101 kan virke som eneste behandling. Den kan stabilisere kreftsykdommen som vist i de nylig publiserte studiene, men medisinen kan også hjelpe cellegift til å virke enda bedre slik at man slipper å ta så mye av den, sier Otterlei.
Fra oppdagelse til kreftmedisin
Enkelt sagt ødelegger den nye kreftmedisinen cellenes evne til å håndtere stress slik at de dør.
Litt mer komplisert sagt er den nye kreftmedisinen et peptid som inneholder en spesiell bindingssekvens, APIM, som finnes i mange ulike proteiner som binder seg til et koordinatormolekyl som heter PCNA.
Hvis du fortsatt henger med, så er forklaringen videre at det er mer enn 500 proteiner som potensielt kan binde til dette koordinatormolekylet.
– Halvparten inneholder bindingssekvensene som vi oppdaget, og gav navnet APIM. Vi fant at APIM-sekvensen brukes for å binde seg til PCNA hovedsakelig under stress, og er viktig for å regulere stress i cellen. Dersom man kan blokkerer disse bindingene vil stressreguleringen bli ødelagt, sier Otterlei.
Alt dette høres jo like enkelt og greit som alt som er strevsomt kan høres ut i ettertid.
Men veien fra den biologisk oppdagelsen på laboratoriet til bruken av denne kunnskapen til behandling av mennesker har tatt 18 år.
Den første hindringen er at man må lage en medisin som virker på samme måten som den biologiske oppdagelsen.
Ingen reell legemiddelindustri i Norge
Etter mange år med å prøve og feile og prøve og feile og prøve og feil klarte Otterlei og teamet å lage medisinen, og kunne ta patent.
På samme tid jobbet teamet med å forstå hvordan koordinatormolekylet PCNA regulerte ulike stressfunksjoner. Nylig publiserte Otterlei og kollegaer ved NTNU en artikkel som viste at PCNA har en helt nyoppdaget rolle som regulator av metabolismen i cellene våre.
Denne rollen tror de er veldig viktig for den stabiliserende effekten de ser av medisinen på kreftpasienter.
All grunnforskning er utført ved NTNU, men ettersom et universitet ikke kan være en kommersiell aktør og lage medisin, måtte Otterlei starte et firma og starte en helt annen jakt enn akademisk publisering.
Pengejakten
Nemlig jakten på penger og investorer.
– Vi har ingen legemiddelindustri for nye medisiner i Norge. Det vi jobber med er for langsiktig for de fleste investorer i Norge. Kliniske forsøk koster fra hundre millioner og oppover, og det er veldig vanskelig å få tak i nok penger. De store farmaselskapene vil gjerne ha resultater fra klinisk fase to før de er interessert, sier Otterlei.
Det har også vært problematisk å få støtte til grunnforskningen rundt selve den biologiske oppdagelse, mye på grunn av at Otterlei har prøvd å kommersialisere og lage en medisin.
– Jeg har søkt og søkt og søkt og søkt. Uten internstøtte fra NTNU hadde det ikke blitt noe av, sier Otterlei.
Nå sjekkes effekten av kreftmedisinen
Nå har utviklingen kommet over i fase to. Under uttestingen i Australia (fase en) skulle man vise at medisinen ikke var giftig. Under fase to skal man vise hvilken effekt medisinen har.
Dette pågår nå.
I USA skal medisinen nå testes på pasienter med sarkom, en type bindevevskreft og i Australia skal medisinen testes på kreft i eggstokkene – begge de kliniske forsøkene er i kombinasjon med cellegift.
Selv om resultatene derfra blir gode, er veien videre fortsatt usikker.
– Det er nok mye som kan virke, men som ikke blir utviklet. Legemiddelindustrien tar ikke over et prosjekt som de ikke kan tjene penger på. Det vi utvikler må virke litt bedre enn nåværende medisin, og helst være billigere å produsere og ha færre bivirkninger. Først da kan et dyrt utviklingsløp lønne seg. Det har vært et langt løp, og selv om alt ser veldig lovende ut foreløpig, er det et stykke igjen før eventuelt pasienter får nytte av dette, sier Otterlei.
Kilder:
PCNA regulates primary metabolism by scaffolding metabolic enzymes. Røst LM, Ræder SB, Olaisen C, Søgaard CK, Sharma A, Bruheim P, Otterlei M.Oncogene. 2023 Feb;42(8):613-624. doi: 10.1038/s41388-022-02579-1. Epub 2022 Dec 23.PMID: 36564470
ATX-101, a cell-penetrating protein targeting PCNA, can be safely administered as intravenous infusion in patients and shows clinical activity in a Phase 1 study.Lemech CR, Kichenadasse G, Marschner JP, Alevizopoulos K, Otterlei M, Millward M.Oncogene. 2023 Feb;42(7):541-544. doi: 10.1038/s41388-022-02582-6. Epub 2022 Dec 23.PMID: 36564469
Identification of a novel, widespread, and functionally important PCNA-binding motif.Gilljam KM, Feyzi E, Aas PA, Sousa MM, Müller R, Vågbø CB, Catterall TC, Liabakk NB, Slupphaug G, Drabløs F, Krokan HE, Otterlei M.J Cell Biol. 2009 Sep 7;186(5):645-54. doi: 10.1083/jcb.200903138.PMID: 19736315



































